Zu Anfang herrscht Freude
Die wohl schönste und aufregendste Zeit im Kalenderjahr dürfte bei jedem Halter von  Morelia viridis die Zuchtphase sein.
Morelia viridis die Zuchtphase sein.  Das ganze Jahr über wird darauf hingearbeitet. Man versucht die Tiere schonend auf optimale Zuchtkondition aufzubauen. Da wir heute vernünftigerweise meist NZ Tiere erwerben, kann dies unter Umständen 4-5 Jahre dauern. Ist es dann endlich soweit werden die Tiere verpaart. Auf die Zucht
Das ganze Jahr über wird darauf hingearbeitet. Man versucht die Tiere schonend auf optimale Zuchtkondition aufzubauen. Da wir heute vernünftigerweise meist NZ Tiere erwerben, kann dies unter Umständen 4-5 Jahre dauern. Ist es dann endlich soweit werden die Tiere verpaart. Auf die Zucht  Grüner Baumpythons möchte ich an
Grüner Baumpythons möchte ich an  dieser Stelle nicht weiter eingehen, da es mittlerweile gute Fachliteratur gibt, die man als ambitionierter Halter sowie Neueinsteiger durcharbeiten sollte ( Arth & Baus 2006, Weier & Vitt 1999, Maxwell 2005 ). Nach erfolgter Paarung und Eiablage muss das Gelege bebrütet werden.
dieser Stelle nicht weiter eingehen, da es mittlerweile gute Fachliteratur gibt, die man als ambitionierter Halter sowie Neueinsteiger durcharbeiten sollte ( Arth & Baus 2006, Weier & Vitt 1999, Maxwell 2005 ). Nach erfolgter Paarung und Eiablage muss das Gelege bebrütet werden. Ob durch das
Ob durch das  Muttertier oder mit Hilfe eines
Muttertier oder mit Hilfe eines  geeigneten Inkubators muss jeder Halter selbst entscheiden. Neueinsteiger gehen optimistisch, ja voller Hoffnung und Erwartung, in das Brutgeschäft. Gerade bei erfahrenen Züchtern stellt sich ab diesem
geeigneten Inkubators muss jeder Halter selbst entscheiden. Neueinsteiger gehen optimistisch, ja voller Hoffnung und Erwartung, in das Brutgeschäft. Gerade bei erfahrenen Züchtern stellt sich ab diesem  Moment leider ein ungutes Gefühl
Moment leider ein ungutes Gefühl  in der Magengegend ein.
in der Magengegend ein.
Es wird die nächsten 49 bis 55 Tage leider nicht erlischen. Es ist die Angst vor im Ei abgestorbenen, augenscheinlich voll entwickelten Neonaten: Dem Ei-tot.
Gedanken vorab
Nach der Eiablage werden die Eier, zumindest bei künstlicher Inkubation,  mit einer Schierlampe durchleuchtet und mit der Keimscheibe nach oben in die vorbereitete Brutbox überführt.
mit einer Schierlampe durchleuchtet und mit der Keimscheibe nach oben in die vorbereitete Brutbox überführt.  In den ersten 8 -14 Tagen werden alle nicht lebensfähigen Eier anfangen zu schimmeln und letztendlich kollabieren.
In den ersten 8 -14 Tagen werden alle nicht lebensfähigen Eier anfangen zu schimmeln und letztendlich kollabieren.  Eier die Tag 20 überstehen, haben eine gute Chance tatsächlich zum Schlupf gebracht zu werden (pers. Beob.). Eine100% Schlupfrate ist bei Morelia viridis eher die Ausnahme, wurde aber auch schon öfter erreicht (V. Bauer, M Weier pers. Mittlg.).
Eier die Tag 20 überstehen, haben eine gute Chance tatsächlich zum Schlupf gebracht zu werden (pers. Beob.). Eine100% Schlupfrate ist bei Morelia viridis eher die Ausnahme, wurde aber auch schon öfter erreicht (V. Bauer, M Weier pers. Mittlg.).  Falls das Gelege tatsächlich voll befruchtet ist und die Elterntiere in guter Verfassung waren, werden sich in der Regel nur 2-3 Eier verabschieden. Dies ist ein normaler Vorgang und stellt keine weiteren Probleme dar. Die Beschalung der Eier ist leider nicht immer perfekt. Solche Gelege sind natürlich wesentlich anfälliger gegen sämtliche Umwelteinflüsse und kippen schneller als Eier mit guter und makelloser Beschalung.
Falls das Gelege tatsächlich voll befruchtet ist und die Elterntiere in guter Verfassung waren, werden sich in der Regel nur 2-3 Eier verabschieden. Dies ist ein normaler Vorgang und stellt keine weiteren Probleme dar. Die Beschalung der Eier ist leider nicht immer perfekt. Solche Gelege sind natürlich wesentlich anfälliger gegen sämtliche Umwelteinflüsse und kippen schneller als Eier mit guter und makelloser Beschalung. 
 Aber auch aus schlecht beschalten Eiern, Eiern mit durchsichtigen aus Kalkmangel resultieren “Fenstern“, ja sogar aus Eiern mit Schimmelbefall, können ohne weiteres gesunde Jungtiere schlüpfen (pers. Beob.). Optische Anomalien der Eioberfläche entscheiden nicht zwingend über den Ausgang des Brutgeschäftes. Gerade in den letzten Tagen der Inkubation werden einzelne Eier bis hin zum gesamten Gelege oft unansehnlich.
Aber auch aus schlecht beschalten Eiern, Eiern mit durchsichtigen aus Kalkmangel resultieren “Fenstern“, ja sogar aus Eiern mit Schimmelbefall, können ohne weiteres gesunde Jungtiere schlüpfen (pers. Beob.). Optische Anomalien der Eioberfläche entscheiden nicht zwingend über den Ausgang des Brutgeschäftes. Gerade in den letzten Tagen der Inkubation werden einzelne Eier bis hin zum gesamten Gelege oft unansehnlich. Vormals pralle, weiße Eier fallen beängstigend ein und bekommen farbige, meist bräunliche Flecken und Ränder. Bis zu diesem Punkt ist alles völlig normal und liegt im üblichen Rahmen. Bei einem solchen Verlauf braucht man sich keine Gedanken zu machen. Was aber viele Züchter weltweit quält, ist das Absterben voll entwickelter Jungtier in der letzten Phase ihrer Entwicklung, bzw. direkt vor, während
Vormals pralle, weiße Eier fallen beängstigend ein und bekommen farbige, meist bräunliche Flecken und Ränder. Bis zu diesem Punkt ist alles völlig normal und liegt im üblichen Rahmen. Bei einem solchen Verlauf braucht man sich keine Gedanken zu machen. Was aber viele Züchter weltweit quält, ist das Absterben voll entwickelter Jungtier in der letzten Phase ihrer Entwicklung, bzw. direkt vor, während oder gleich unmittelbar nach dem Schlupf.
oder gleich unmittelbar nach dem Schlupf.  Es scheint als sei kein Halter Grüner Baumpythons gegen diese Laune der Natur gefeit. Immer wieder kommt es zum Verlust einzelner schlupfreifer Tiere, bis hin zum Absterben ganzer Gelege. Trotz größter Bemühungen und ausgefeilter Bruttechnik. Zu Beginn sollte man sich daher über die einzelnen Faktoren im Klaren werden, die zu einer problemlosen Eizeitigung sowie einem erfolgreichen Schlupf beitragen können.
Es scheint als sei kein Halter Grüner Baumpythons gegen diese Laune der Natur gefeit. Immer wieder kommt es zum Verlust einzelner schlupfreifer Tiere, bis hin zum Absterben ganzer Gelege. Trotz größter Bemühungen und ausgefeilter Bruttechnik. Zu Beginn sollte man sich daher über die einzelnen Faktoren im Klaren werden, die zu einer problemlosen Eizeitigung sowie einem erfolgreichen Schlupf beitragen können.
Die Elterntiere
Man geht davon aus, dass nur optimal konditionierte und gesunde Tiere zur Zucht verwendet werden.  Je besser die Verfassung der Zuchttiere ist, desto vitaler werden in der Regel letztendlich die Eier werden. Tiere mit bekannten gesundheitlichen Mängeln werden nicht zur Zucht herangezogen. Die Gesundheit, gerade des Muttertieres, ist von nachhaltiger Bedeutung. Da die Jungtiere in ihren Eiern für ihre Entwicklung ca. 49-55 Tage bis zu ihrem Schlupf benötigen, ist die Versorgung mit lebenswichtigen Vitaminen, Mineralien und Nährstoffen natürlich von oberster Priorität. Da die Grundversorgung der Eier natürlich maßgeblich vom Weibchen abhängt, ist eine langfristig, qualitative Ernährung der Schlangen, von grundlegender Bedeutung.
Je besser die Verfassung der Zuchttiere ist, desto vitaler werden in der Regel letztendlich die Eier werden. Tiere mit bekannten gesundheitlichen Mängeln werden nicht zur Zucht herangezogen. Die Gesundheit, gerade des Muttertieres, ist von nachhaltiger Bedeutung. Da die Jungtiere in ihren Eiern für ihre Entwicklung ca. 49-55 Tage bis zu ihrem Schlupf benötigen, ist die Versorgung mit lebenswichtigen Vitaminen, Mineralien und Nährstoffen natürlich von oberster Priorität. Da die Grundversorgung der Eier natürlich maßgeblich vom Weibchen abhängt, ist eine langfristig, qualitative Ernährung der Schlangen, von grundlegender Bedeutung.  Die Jungschlangen müssen mit den zur Eiablage bereitgestellten Vorräten auskommen. Meinen Beobachtungen zufolge, sind kleinere Gelege meist mit höheren Schlupfquoten zu zeitigen als extrem große Gelege. Weibliche Morelia viridis, die über 1500g wiegen, ja sogar an 2kg kommen, können Gelege bis zu 36 Eier produzieren (pers. Beob.). Der Schlupferfolg wird meinen Beobachtungen nach aber deutlich geringer als mit Tieren die nur 18 bis 25 Eier ablegen. Ähnlich wie Kuchen, der bei vielen Gästen in immer kleinere Stücke geteilt werden muss.
Die Jungschlangen müssen mit den zur Eiablage bereitgestellten Vorräten auskommen. Meinen Beobachtungen zufolge, sind kleinere Gelege meist mit höheren Schlupfquoten zu zeitigen als extrem große Gelege. Weibliche Morelia viridis, die über 1500g wiegen, ja sogar an 2kg kommen, können Gelege bis zu 36 Eier produzieren (pers. Beob.). Der Schlupferfolg wird meinen Beobachtungen nach aber deutlich geringer als mit Tieren die nur 18 bis 25 Eier ablegen. Ähnlich wie Kuchen, der bei vielen Gästen in immer kleinere Stücke geteilt werden muss. 
 Bei zu vielen Kostgängern wird letztendlich keiner der Gäste mehr richtig satt. Da das Ei als Vorratsspeicher des neuen Lebens dient, müssen alle nötigen Vitamine und Mineralien in ausreichender Menge vorhanden sein. Es erscheint mir logisch, dass weniger Eier einfach besser mit den benötigten Inhaltsstoffen versorgt sind. Dies ist aber lediglich eine Theorie und bedürfte zur Untermauerung natürlich einiger fundierten chem / biologischen Untersuchungsreihen im Labor. Wilson hat bei seinen feldherpetologischen Untersuchungen in den Wäldern Nord Australiens, der Iron Range, zwischen 2002 und 2005 Morelia viridis gesammelt und vermessen (Wilson 2011). Das größte und älteste Tier war lediglich 142cm lang SVL (Schnauzenspitze bis Kloakenöffnung), wog ca. 617g. und wurde auf ein Alter von 12 Jahren bestimmt.
Bei zu vielen Kostgängern wird letztendlich keiner der Gäste mehr richtig satt. Da das Ei als Vorratsspeicher des neuen Lebens dient, müssen alle nötigen Vitamine und Mineralien in ausreichender Menge vorhanden sein. Es erscheint mir logisch, dass weniger Eier einfach besser mit den benötigten Inhaltsstoffen versorgt sind. Dies ist aber lediglich eine Theorie und bedürfte zur Untermauerung natürlich einiger fundierten chem / biologischen Untersuchungsreihen im Labor. Wilson hat bei seinen feldherpetologischen Untersuchungen in den Wäldern Nord Australiens, der Iron Range, zwischen 2002 und 2005 Morelia viridis gesammelt und vermessen (Wilson 2011). Das größte und älteste Tier war lediglich 142cm lang SVL (Schnauzenspitze bis Kloakenöffnung), wog ca. 617g. und wurde auf ein Alter von 12 Jahren bestimmt.  Abhängig von den Fütterungsintervallen würde ein Tier unter Terrarienbedingungen die gleiche Größe in 3 – 4 Jahren erlangen.
Abhängig von den Fütterungsintervallen würde ein Tier unter Terrarienbedingungen die gleiche Größe in 3 – 4 Jahren erlangen.  Gerade das natürliche Wachstum der Jungtiere dürfte in den
Gerade das natürliche Wachstum der Jungtiere dürfte in den  ersten 2 -3 Lebensjahren wesentlich langsamer voranschreiten, da ihre Nahrung lediglich aus kleinen Reptilien und Insekten besteht. Erst im späteren Alter und einer Länge über 80cm, wird die Nahrungspalette auf warmblütige Nager wie die Mosaikschwanzratte (Melomys capensis) bzw. der Cape York Ratte (Rattus leucopus), erweitert (Wilson 2006). Auch die Frequenz der Fortpflanzungszyklen ist in freier Natur wahrscheinlich wesentlich niedriger als in menschlicher Obhut. Da in freier Natur eine lückenlose Versorgung mit kalorienreichen Futtertieren natürlich nicht sichergestellt ist, werden vermutlich 2-3 Jahre vergehen um ein neues Gelege zu entwickeln. Außerdem muss das Weibchen, wenn es Follikel entwickelt hat, auch einen Partner zur Kopulation finden. Wie dicht der Bestand im Habitat ist, kann man als Terrarianer auch nur schwer abschätzen. Die Freilandbeobachtungen, die z. B. Karl Heinz Switak auf seinen feldherpetologischen Reisen gemacht hat, lassen eher auf eine spärliche Dichte schließen (Switak 2006). Wobei hierbei beachtet werden muss, dass diese Eindrücke 1971 bis 1973 gesammelt wurden und der Bestand der freilebenden Morelia viridis zu dieser Zeit vermutlich üppiger war als in den heutigen Tagen. Einher mit der optimalen Futterversorgung der Elterntiere geht eine abgestimmte Haltung beider Geschlechter. Zum Thema Haltung und Terrarientechnik gibt es ebenfalls ausgearbeitete Literatur (Maxwell 2005, Kroneis 2010, Weier & Vitt 1999). Ein Absenken der nächtlichen Temperaturen scheint bei den meisten Züchtern eine Steigerung der Befruchtungsquote auszulösen (Maxwell 2005 ).
ersten 2 -3 Lebensjahren wesentlich langsamer voranschreiten, da ihre Nahrung lediglich aus kleinen Reptilien und Insekten besteht. Erst im späteren Alter und einer Länge über 80cm, wird die Nahrungspalette auf warmblütige Nager wie die Mosaikschwanzratte (Melomys capensis) bzw. der Cape York Ratte (Rattus leucopus), erweitert (Wilson 2006). Auch die Frequenz der Fortpflanzungszyklen ist in freier Natur wahrscheinlich wesentlich niedriger als in menschlicher Obhut. Da in freier Natur eine lückenlose Versorgung mit kalorienreichen Futtertieren natürlich nicht sichergestellt ist, werden vermutlich 2-3 Jahre vergehen um ein neues Gelege zu entwickeln. Außerdem muss das Weibchen, wenn es Follikel entwickelt hat, auch einen Partner zur Kopulation finden. Wie dicht der Bestand im Habitat ist, kann man als Terrarianer auch nur schwer abschätzen. Die Freilandbeobachtungen, die z. B. Karl Heinz Switak auf seinen feldherpetologischen Reisen gemacht hat, lassen eher auf eine spärliche Dichte schließen (Switak 2006). Wobei hierbei beachtet werden muss, dass diese Eindrücke 1971 bis 1973 gesammelt wurden und der Bestand der freilebenden Morelia viridis zu dieser Zeit vermutlich üppiger war als in den heutigen Tagen. Einher mit der optimalen Futterversorgung der Elterntiere geht eine abgestimmte Haltung beider Geschlechter. Zum Thema Haltung und Terrarientechnik gibt es ebenfalls ausgearbeitete Literatur (Maxwell 2005, Kroneis 2010, Weier & Vitt 1999). Ein Absenken der nächtlichen Temperaturen scheint bei den meisten Züchtern eine Steigerung der Befruchtungsquote auszulösen (Maxwell 2005 ). Speziell die männlichen Tiere scheinen oft vitaleres Sperma während einer kühleren Phase der Haltung zu produzieren. Weibliche Tiere beginnen in der Regel mit der Entwicklung von Follikeln während dieser Zeit. Ein weiterer Vorteil ist die zeitliche Synchronisation beider Geschlechter innerhalb eines grob abgesteckten Zeitrahmens.
Speziell die männlichen Tiere scheinen oft vitaleres Sperma während einer kühleren Phase der Haltung zu produzieren. Weibliche Tiere beginnen in der Regel mit der Entwicklung von Follikeln während dieser Zeit. Ein weiterer Vorteil ist die zeitliche Synchronisation beider Geschlechter innerhalb eines grob abgesteckten Zeitrahmens.  Es gibt allerdings auch immer wieder erfolgreiche Zuchtversuche ohne merkliche nächtliche Abkühlung der Tiere (K. Ecker pers. Mittlg.). Meine erste Nachzucht entstand fast zufällig in Folge einer Augustpaarung eines sehr heißen Sommers. Die Jungen schlüpften schon Anfang Dezember. Von einer einleitenden Abkühlung meiner damaligen Dachwohnung konnte keine Rede sein. Da während der Brut aber noch viele weitere Unbekannte vorhanden sind, die unmittelbar die Nachzucht beeinflussen, würde ich dieses vermeidbare Risiko immer minimieren und beide Tiere nächtlicher Abkühlung aussetzen.
Es gibt allerdings auch immer wieder erfolgreiche Zuchtversuche ohne merkliche nächtliche Abkühlung der Tiere (K. Ecker pers. Mittlg.). Meine erste Nachzucht entstand fast zufällig in Folge einer Augustpaarung eines sehr heißen Sommers. Die Jungen schlüpften schon Anfang Dezember. Von einer einleitenden Abkühlung meiner damaligen Dachwohnung konnte keine Rede sein. Da während der Brut aber noch viele weitere Unbekannte vorhanden sind, die unmittelbar die Nachzucht beeinflussen, würde ich dieses vermeidbare Risiko immer minimieren und beide Tiere nächtlicher Abkühlung aussetzen.  Sind die Tiere erst einmal verpaart und hat das Weibchen Follikel gebildet, sowie hinterher eine erfolgreiche Ovulation durchlaufen, sollte der Haltung ein besonderes Augenmerk geschenkt werden. Dem trächtigen Weibchen wird auch nachts eine Möglichkeit bereitgestellt um sich mild aufzuwärmen. Tagestemperaturen von 31 bis 32 Grad Celsius sollen jetzt an einem Hotspot angeboten werden. Nachtwerte auf diesem Platz von 24 -26 Grad sind förderlich für eine weitere gute Entwicklung. Der Rest des Terrariums kann bedenkenlos auf nächtliche Werte von 23-24 Grad Celsius abfallen.
Sind die Tiere erst einmal verpaart und hat das Weibchen Follikel gebildet, sowie hinterher eine erfolgreiche Ovulation durchlaufen, sollte der Haltung ein besonderes Augenmerk geschenkt werden. Dem trächtigen Weibchen wird auch nachts eine Möglichkeit bereitgestellt um sich mild aufzuwärmen. Tagestemperaturen von 31 bis 32 Grad Celsius sollen jetzt an einem Hotspot angeboten werden. Nachtwerte auf diesem Platz von 24 -26 Grad sind förderlich für eine weitere gute Entwicklung. Der Rest des Terrariums kann bedenkenlos auf nächtliche Werte von 23-24 Grad Celsius abfallen.
Die Qualität der Eier
Die Qualität der Eier Eier von Morelia viridis sind oft von unterschiedlicher Erscheinung sowie Qualität. Als “Wiege des Lebens“ unterscheiden sich Schlangeneier nicht wesentlich von Vogeleiern (Bellairs 1971). Der Schale werden aber weit größere Funktionen zugesprochen als ein überwiegend mechanischer Schutz gegen Umwelteinflüsse.  Manche Gelege lassen sich verhältnismäßig einfach bebrüten, andere wiederum mit hohen Ausfällen bei identischer Bruttechnik und Haltung der Elterntiere. Als Barriere gegenüber äußeren Einflüssen, sowie stetiges Bindeglied zu lebenswichtigem Sauerstoff, liegt die Schale zwischen dem heranwachsenden Jungtier und seiner Umwelt. Sie ist bei Eiern des Grünen Baumpythons von weicher und elastischer Beschaffenheit.
Manche Gelege lassen sich verhältnismäßig einfach bebrüten, andere wiederum mit hohen Ausfällen bei identischer Bruttechnik und Haltung der Elterntiere. Als Barriere gegenüber äußeren Einflüssen, sowie stetiges Bindeglied zu lebenswichtigem Sauerstoff, liegt die Schale zwischen dem heranwachsenden Jungtier und seiner Umwelt. Sie ist bei Eiern des Grünen Baumpythons von weicher und elastischer Beschaffenheit.  Frisch abgelegt sind Sie manchmal fleckig und sehen wenig erfolgversprechend aus. Bereits nach wenigen Stunden verfestigen sich die Eier in der Regel leicht und verändern ihre Farbe oft in ein strahlendes Reinweiß. Als hoffnungsvoll und beruhigend gelten reinweiße Eier, ohne jegliche Flecken oder Verfärbungen, mit gleichmäßiger, leicht poröser Oberfläche. Der Gesamteindruck sollte durch die komplette Brutzeit elastisch und flexibel bleiben. Keinesfalls fest, hart oder gar brüchig werden. Gerade gegen Ende trocknen die Eier gerne zu sehr aus und bekommen eine feste, kartonartige Schale. Für ein Jungtier ein unüberwindbares Hindernis. Aber nicht nur für die Schlangen in der Schlupfphase, nein während der kompletten Entwicklung dient die Schale als Membrane zum Gasaustausch mit der Außenluft bzw. der Regulierung des Wasserhaushaltes (Nietzke 1984, Köhler 1997). Leider sind optisch gute Gelege auch kein Garant für eine hohe Schlupfrate. Auch diese, augenscheinlich makellosen Eier, können ihre Optik innerhalb 24 Stunden drastisch verändern.
Frisch abgelegt sind Sie manchmal fleckig und sehen wenig erfolgversprechend aus. Bereits nach wenigen Stunden verfestigen sich die Eier in der Regel leicht und verändern ihre Farbe oft in ein strahlendes Reinweiß. Als hoffnungsvoll und beruhigend gelten reinweiße Eier, ohne jegliche Flecken oder Verfärbungen, mit gleichmäßiger, leicht poröser Oberfläche. Der Gesamteindruck sollte durch die komplette Brutzeit elastisch und flexibel bleiben. Keinesfalls fest, hart oder gar brüchig werden. Gerade gegen Ende trocknen die Eier gerne zu sehr aus und bekommen eine feste, kartonartige Schale. Für ein Jungtier ein unüberwindbares Hindernis. Aber nicht nur für die Schlangen in der Schlupfphase, nein während der kompletten Entwicklung dient die Schale als Membrane zum Gasaustausch mit der Außenluft bzw. der Regulierung des Wasserhaushaltes (Nietzke 1984, Köhler 1997). Leider sind optisch gute Gelege auch kein Garant für eine hohe Schlupfrate. Auch diese, augenscheinlich makellosen Eier, können ihre Optik innerhalb 24 Stunden drastisch verändern. Wobei auch aus unansehnlichen Eiern, übersät mit Flecken und farblichen Rändern, gesunde und vitale Jungtiere schlüpfen können. Gerade gegen Ende des Brutgeschäftes sehen die Eier optisch oft besorgniserregend aus. Selbst erfahrene Halter kommen dann doch noch ins Zweifeln ob der Ausgang von Erfolg gekrönt sein mag oder das Gelege jetzt sein vorzeitiges Ende findet. Frisch abgelegte Eier sind oft noch nicht prall und mit Längsrillen versehen. Erst nach 2-3 Tagen haben sie ihre endgültige Form erreicht. Gegen Ende des Brutgeschäftes fangen sie dann wieder an einzufallen. Was völlig normal ist, da die Jungtiere im Inneren immer mehr Eidotter und letztendlich auch Eiweiß verbrauchen. Fallen die Eier hingegen nach 4-5 Wochen nicht ein, liegt womöglich eine zu hohe Substrat oder Luftfeuchte vor bzw. die Eischale ist nicht 100% funktionsfähig. Unter Umständen erlaubt die pergamentartige Schale dem Ei keinen Transfer von Flüssigkeit, oder schlimmer Kohlendioxyd, an seine unmittelbare Umwelt abzugeben. Gerade gegen Ende der Brut steigt der Kohlendioxidgehalt des Eies erheblich, wobei jetzt ein erhöhter Sauerstoffbedarf zu verzeichnen ist (Köhler 1997). Ich habe selbst bei einer künstlichen Inkubation beobachten können, wie einzelne Eier eines Geleges förmlich geplatzt sind und einige Tropfen Eiweiß über sich ergossen (pers. Beobachtung 2010). Dieser Zwischenfall geschah ohne jegliche Erschütterung oder Fremdeinwirkung zwischen Tag 20 und 30 der Inkubation. Keines dieser Eier konnte zum Schlupf gebracht werden, obwohl die schadhaften Stellen direkt mit alten Eihüllen verschlossen und mit Kohlestaub abgepudert wurden. Solche schadhaften Stellen sind natürlich willkommene Eingangspforten für sämtliche unliebsamen Keime, Sporen und Bakterien. Bei leichtem Pilzbefall kann eine Behandlung mit Kohlestaub die schützende Wirkung, der ohnehin vorhandenen Schutzhülle eines vitalen Eies positiv verstärken. Eine antimykotische Schutzhülle bringen Reptilieneier von Haus aus mit sich (Köhler 1997). Da Eier von Morelia viridis, in einer sehr feuchtigkeitsgesättigten Atmosphäre gezeitigt werden, ist diese dringend notwendig um sämtlichen Pilzkulturen und Bakterien entgegen wirken zu können. Der Verwendung einer Antimykotischen Salbe, im Falle leichten Schimmelbefalls, kann ich an dieser Stelle nur abraten, da sie die lebenswichtigen Poren der Eischale verschließt und unweigerlich zum absterben des Inhaltes führt ( pers. Beobachtung 2006). Die Lageveränderung eines Geleges ist ebenfalls ein strittiges Thema in der Haltung von Schlangen. In allen Standardwerken wird von einem drehen der Eier nach dem Anwachsen der Keimscheibe abgeraten (Köhler 1997, Nietzke 1984, Bellairs 1971). In den ersten Stunden nach der Ablage, scheint eine Lageveränderung allerdings keine Auswirkungen auf den späteren Brutverlauf zu haben. Die Keimscheibe orientiert sich zu Anfang wieder neu an der Ei Oberseite (pers. Beobachtung). Ebenso ist das standardisierte Trennen der Eier ein gewagtes Unterfangen, falls die Keimscheibe ihre Lage schon fixiert hat. Je länger die Eier liegen desto größer ist die Gefahr, bei unsachgemäßem Umgang die feinen Verbindungen im inneren der Eier zu beschädigen, was im späteren Brutverlauf womöglich nachhaltige Schäden verursacht. Ob das gerade bei amerikanischen Züchtern häufig praktizierte Trennen der Eier wirklich in jedem Fall empfehlenswert ist, sei dahingestellt. Es gibt etliche Brutversuche mit kompletten Eihaufen die ebenfalls erfolgreich gezeitigt wurden (pers. Beobachtung). Einzelne Eier bieten natürlich den entscheidenden Vorteil, falls notwendig jederzeit vom restlichen Gelege getrennt werden zu können. Die Beurteilung frisch abgelegter Eier eines Grünen Baumpythons bedarf ohne Zweifel einer gewissen Erfahrung. Aber auch routinierte Halter sind oft vom erwartenden Ausgang einer folgenden Brut überrascht. Im positiven wie im negativen Sinne. Gerade deswegen sollte jedes Ei unbedingt seine Chance in einem Inkubator bekommen. Alles Weitere zeigt sich dann während der Brut.
Wobei auch aus unansehnlichen Eiern, übersät mit Flecken und farblichen Rändern, gesunde und vitale Jungtiere schlüpfen können. Gerade gegen Ende des Brutgeschäftes sehen die Eier optisch oft besorgniserregend aus. Selbst erfahrene Halter kommen dann doch noch ins Zweifeln ob der Ausgang von Erfolg gekrönt sein mag oder das Gelege jetzt sein vorzeitiges Ende findet. Frisch abgelegte Eier sind oft noch nicht prall und mit Längsrillen versehen. Erst nach 2-3 Tagen haben sie ihre endgültige Form erreicht. Gegen Ende des Brutgeschäftes fangen sie dann wieder an einzufallen. Was völlig normal ist, da die Jungtiere im Inneren immer mehr Eidotter und letztendlich auch Eiweiß verbrauchen. Fallen die Eier hingegen nach 4-5 Wochen nicht ein, liegt womöglich eine zu hohe Substrat oder Luftfeuchte vor bzw. die Eischale ist nicht 100% funktionsfähig. Unter Umständen erlaubt die pergamentartige Schale dem Ei keinen Transfer von Flüssigkeit, oder schlimmer Kohlendioxyd, an seine unmittelbare Umwelt abzugeben. Gerade gegen Ende der Brut steigt der Kohlendioxidgehalt des Eies erheblich, wobei jetzt ein erhöhter Sauerstoffbedarf zu verzeichnen ist (Köhler 1997). Ich habe selbst bei einer künstlichen Inkubation beobachten können, wie einzelne Eier eines Geleges förmlich geplatzt sind und einige Tropfen Eiweiß über sich ergossen (pers. Beobachtung 2010). Dieser Zwischenfall geschah ohne jegliche Erschütterung oder Fremdeinwirkung zwischen Tag 20 und 30 der Inkubation. Keines dieser Eier konnte zum Schlupf gebracht werden, obwohl die schadhaften Stellen direkt mit alten Eihüllen verschlossen und mit Kohlestaub abgepudert wurden. Solche schadhaften Stellen sind natürlich willkommene Eingangspforten für sämtliche unliebsamen Keime, Sporen und Bakterien. Bei leichtem Pilzbefall kann eine Behandlung mit Kohlestaub die schützende Wirkung, der ohnehin vorhandenen Schutzhülle eines vitalen Eies positiv verstärken. Eine antimykotische Schutzhülle bringen Reptilieneier von Haus aus mit sich (Köhler 1997). Da Eier von Morelia viridis, in einer sehr feuchtigkeitsgesättigten Atmosphäre gezeitigt werden, ist diese dringend notwendig um sämtlichen Pilzkulturen und Bakterien entgegen wirken zu können. Der Verwendung einer Antimykotischen Salbe, im Falle leichten Schimmelbefalls, kann ich an dieser Stelle nur abraten, da sie die lebenswichtigen Poren der Eischale verschließt und unweigerlich zum absterben des Inhaltes führt ( pers. Beobachtung 2006). Die Lageveränderung eines Geleges ist ebenfalls ein strittiges Thema in der Haltung von Schlangen. In allen Standardwerken wird von einem drehen der Eier nach dem Anwachsen der Keimscheibe abgeraten (Köhler 1997, Nietzke 1984, Bellairs 1971). In den ersten Stunden nach der Ablage, scheint eine Lageveränderung allerdings keine Auswirkungen auf den späteren Brutverlauf zu haben. Die Keimscheibe orientiert sich zu Anfang wieder neu an der Ei Oberseite (pers. Beobachtung). Ebenso ist das standardisierte Trennen der Eier ein gewagtes Unterfangen, falls die Keimscheibe ihre Lage schon fixiert hat. Je länger die Eier liegen desto größer ist die Gefahr, bei unsachgemäßem Umgang die feinen Verbindungen im inneren der Eier zu beschädigen, was im späteren Brutverlauf womöglich nachhaltige Schäden verursacht. Ob das gerade bei amerikanischen Züchtern häufig praktizierte Trennen der Eier wirklich in jedem Fall empfehlenswert ist, sei dahingestellt. Es gibt etliche Brutversuche mit kompletten Eihaufen die ebenfalls erfolgreich gezeitigt wurden (pers. Beobachtung). Einzelne Eier bieten natürlich den entscheidenden Vorteil, falls notwendig jederzeit vom restlichen Gelege getrennt werden zu können. Die Beurteilung frisch abgelegter Eier eines Grünen Baumpythons bedarf ohne Zweifel einer gewissen Erfahrung. Aber auch routinierte Halter sind oft vom erwartenden Ausgang einer folgenden Brut überrascht. Im positiven wie im negativen Sinne. Gerade deswegen sollte jedes Ei unbedingt seine Chance in einem Inkubator bekommen. Alles Weitere zeigt sich dann während der Brut.
Zur Bruttechnik
Gelege von Morelia viridis können auf mehrere Arten gezeitigt werden. Generell ist die natürliche und künstliche Inkubation voneinander zu unterscheiden. Der Ausgang beider Bruttechniken, im Bezug auf das Absterben voll entwickelter Jungtiere im Ei, scheint mittlerweile recht ausgewogen zu sein. Für beide Verfahren gibt es Verfechter, die auf ihrem Gebiet, die Vorgehensweise und Technik, weit ausgefeilt haben und somit eine hohe Schlupfquote erzielen. Verständlicherweise schwören alle auf ihre Methode und sind oft wenig offen gegenüber anderen Zeitigungssystemen. Nach dem Motto “ Never Change a Running Sytem“, wird an altbewährtem und erarbeitetem Wissen festgehalten. Gerade der Naturbrut stehen viele Halter skeptisch gegenüber. Solange die Rahmenbedingungen stehen, ist die Chance allerdings sehr hoch, einige Jungtiere nach 50 Tagen schlüpfen zu sehen. Stehen dem brütenden Weibchen Temperaturen um 29 Grad Celsius zur Verfügung, sowie eine relative Luftfeuchte von ca. 90%, ist sie in der Lage ihr Brutgeschäft auszuführen. Das nahezu 100%ige Absterben vitaler Gelege, wie es in künstlichen Brutversuchen immer wieder vorkommt, ist während der Naturbrut eher selten. Ich werde aber nicht weiter im Detail auf Naturbrut eingehen, da ich bereits einen ausführlichen Artikel zu diesem Thema verfasst habe (Kroneis 2010). In der künstlichen Inkubation unterscheiden sich grundlegend die Vorgehensweise der Inkubation auf feuchtem Substrat, wie Vermiculite oder Sphagnummoos, sowie die vollkommen substratlose Eizeitigung über einem Wasserbad.
Das nahezu 100%ige Absterben vitaler Gelege, wie es in künstlichen Brutversuchen immer wieder vorkommt, ist während der Naturbrut eher selten. Ich werde aber nicht weiter im Detail auf Naturbrut eingehen, da ich bereits einen ausführlichen Artikel zu diesem Thema verfasst habe (Kroneis 2010). In der künstlichen Inkubation unterscheiden sich grundlegend die Vorgehensweise der Inkubation auf feuchtem Substrat, wie Vermiculite oder Sphagnummoos, sowie die vollkommen substratlose Eizeitigung über einem Wasserbad. Das Handling beider Systeme hat Vor- und Nachteile. Einen unmittelbaren Zusammenhang mit toten Jungtieren zum Schlupftermin lässt sich bislang allerdings bei beiden Methoden nicht feststellen. Bei allen Verfahren gibt es Anhänger die immer wieder hohe Schlupfquoten erreichen, aber zwischendurch auch Eier verlieren. Von den amerikanischen Terrarianern ist vor einigen Jahren die Inkubation ohne Substrat über den Teich geschwappt. Ohne diese Technik in Frage zu stellen, wird sie nun seither brav von vielen Haltern des Grünen Baumpythons ritualisiert. Wer das Medium Internet aufmerksam nutzt, wird allerdings Berichte aufstöbern, in denen erfolgreich auf Vermiculite oder Sphagnum Gelege von Morelia viridis gezeitigt wurden. Gerade auch im amerikanischen Raum. Europäer trauen sich diese Technik anscheinend nicht mehr, obwohl bei fast allen Reptilieneiern sehr gute Ergebnisse erzielt werden. Den Fokus liegt hierbei immer auf dem Absterben der Jungtiere in der letzten Brutwoche. Gerade bei Eiern des Baumpythons werden feuchte Substrate jedoch durchaus skeptisch betrachtet und von vielen sehr kritisch gesehen. Dem Management des Substrates wird wahrscheinlich sogar zuviel Aufmerksamkeit geschenkt. Gelegentlich wird der Eindruck erweckt es würde das Substrat inkubiert und nicht die Eier (pers. Mittlg. S. Arth). Wie hier treffend erwähnt, gilt es in erster Linie einer aufmerksamen Beobachtung der Eier und nur sekundär dem verwendeten Substrat. Bei Veränderungen wird dort lediglich leicht gegengesteuert. Im Management der Eier während des vorangegangenen Brutgeschäfts gibt es allerdings erhebliche Unterschiede der einzelnen Systeme. Die Wahl der Bruttechnik scheint die Schlupfphase aber nicht unmittelbar zu beeinflussen. Vielmehr scheinen weiterführende Parameter zu Buche zu schlagen. Bruttemperatur und Luftfeuchte liegen bei Grünen Baumpythons in einem recht engen Rahmen. Die Luftfeuchte wird während der gesamten Brut möglichst hoch gehalten. Werte um 90% sind anzustreben. Temperaturen zwischen 29 und 31,5 scheinen der Entwicklung der Neonaten förderlich zu sein. Konstant gehalten oder nach verschiedenen Systemen angehoben und gesenkt, haben leider auf die Sterblichkeitsrate der Jungtiere am Ende der Brutzeit ähnliche Auswirkungen. Alle Systeme können gleichermaßen zum Erfolg oder Misserfolg führen, geht man davon aus, dass bei allen Variationen keine äußeren Einflüsse, wie Tropfwasser oder Erschütterungen, das junge Leben vorzeitig beenden.
Das Handling beider Systeme hat Vor- und Nachteile. Einen unmittelbaren Zusammenhang mit toten Jungtieren zum Schlupftermin lässt sich bislang allerdings bei beiden Methoden nicht feststellen. Bei allen Verfahren gibt es Anhänger die immer wieder hohe Schlupfquoten erreichen, aber zwischendurch auch Eier verlieren. Von den amerikanischen Terrarianern ist vor einigen Jahren die Inkubation ohne Substrat über den Teich geschwappt. Ohne diese Technik in Frage zu stellen, wird sie nun seither brav von vielen Haltern des Grünen Baumpythons ritualisiert. Wer das Medium Internet aufmerksam nutzt, wird allerdings Berichte aufstöbern, in denen erfolgreich auf Vermiculite oder Sphagnum Gelege von Morelia viridis gezeitigt wurden. Gerade auch im amerikanischen Raum. Europäer trauen sich diese Technik anscheinend nicht mehr, obwohl bei fast allen Reptilieneiern sehr gute Ergebnisse erzielt werden. Den Fokus liegt hierbei immer auf dem Absterben der Jungtiere in der letzten Brutwoche. Gerade bei Eiern des Baumpythons werden feuchte Substrate jedoch durchaus skeptisch betrachtet und von vielen sehr kritisch gesehen. Dem Management des Substrates wird wahrscheinlich sogar zuviel Aufmerksamkeit geschenkt. Gelegentlich wird der Eindruck erweckt es würde das Substrat inkubiert und nicht die Eier (pers. Mittlg. S. Arth). Wie hier treffend erwähnt, gilt es in erster Linie einer aufmerksamen Beobachtung der Eier und nur sekundär dem verwendeten Substrat. Bei Veränderungen wird dort lediglich leicht gegengesteuert. Im Management der Eier während des vorangegangenen Brutgeschäfts gibt es allerdings erhebliche Unterschiede der einzelnen Systeme. Die Wahl der Bruttechnik scheint die Schlupfphase aber nicht unmittelbar zu beeinflussen. Vielmehr scheinen weiterführende Parameter zu Buche zu schlagen. Bruttemperatur und Luftfeuchte liegen bei Grünen Baumpythons in einem recht engen Rahmen. Die Luftfeuchte wird während der gesamten Brut möglichst hoch gehalten. Werte um 90% sind anzustreben. Temperaturen zwischen 29 und 31,5 scheinen der Entwicklung der Neonaten förderlich zu sein. Konstant gehalten oder nach verschiedenen Systemen angehoben und gesenkt, haben leider auf die Sterblichkeitsrate der Jungtiere am Ende der Brutzeit ähnliche Auswirkungen. Alle Systeme können gleichermaßen zum Erfolg oder Misserfolg führen, geht man davon aus, dass bei allen Variationen keine äußeren Einflüsse, wie Tropfwasser oder Erschütterungen, das junge Leben vorzeitig beenden.
Schlupf oder Tot der Neonaten
Beim Schlupf zeigt sich die Frucht der Bemühungen. Die Stunden vom selbstständigen Anritzen des ersten Eies, bis zum Verlassen oder Absterben des Letzten, vergehen wie in Zeitlupe.  Ständig ist man in Versuchung manuell in den Verlauf einzugreifen. Stündliche Kontrollgänge zum Inkubator beruhigen die Nerven leider auch nicht. Andere Halter verhalten sich stur nach publizierten Vorgaben oder Systemen und verarzten das Gelege nach einem vorher festgelegten Stundenplan. All diese Bemühungen werden einem Absterben schlupfreifer Jungtiere leider nur bedingt entgegenwirken. Die entscheidenden
Ständig ist man in Versuchung manuell in den Verlauf einzugreifen. Stündliche Kontrollgänge zum Inkubator beruhigen die Nerven leider auch nicht. Andere Halter verhalten sich stur nach publizierten Vorgaben oder Systemen und verarzten das Gelege nach einem vorher festgelegten Stundenplan. All diese Bemühungen werden einem Absterben schlupfreifer Jungtiere leider nur bedingt entgegenwirken. Die entscheidenden  Faktoren scheinen auf einem anderen Gebiet zu liegen. Vielleicht schon viel früher in der Eizeitigung. Meist schlüpfen 1-2 Jungtiere zeitnah, selbstständig und ohne Probleme. Diese Tiere erwecken oft einen agilen Eindruck, der die Hoffnung steigen lässt. In der Kunstbrut kommt jetzt meist eine Pause der langersehnten Schlupfphase bis hin zur nächsten Nacht. Dies scheint auch normal zu sein und wurde öfter von mir beobachtet. Ein nächtliches Verlassen des Brutplatzes, würde in freier Natur wohl die Gefahr gegenüber Fressfeinden herabsetzen, was aber reine Theorie ist und nie beobachtet wurde. Bislang konnte dieses spektakuläre Schauspiel ausschließlich in Gefangenschaft beobachtet werden. Die Jungtiere stiegen dabei immer nachts aus ihren Bruthöhlen und verschwanden zielstrebig in den Blättern der Terrarienbepflanzung.
Faktoren scheinen auf einem anderen Gebiet zu liegen. Vielleicht schon viel früher in der Eizeitigung. Meist schlüpfen 1-2 Jungtiere zeitnah, selbstständig und ohne Probleme. Diese Tiere erwecken oft einen agilen Eindruck, der die Hoffnung steigen lässt. In der Kunstbrut kommt jetzt meist eine Pause der langersehnten Schlupfphase bis hin zur nächsten Nacht. Dies scheint auch normal zu sein und wurde öfter von mir beobachtet. Ein nächtliches Verlassen des Brutplatzes, würde in freier Natur wohl die Gefahr gegenüber Fressfeinden herabsetzen, was aber reine Theorie ist und nie beobachtet wurde. Bislang konnte dieses spektakuläre Schauspiel ausschließlich in Gefangenschaft beobachtet werden. Die Jungtiere stiegen dabei immer nachts aus ihren Bruthöhlen und verschwanden zielstrebig in den Blättern der Terrarienbepflanzung.  Dort konnten sie dann am folgenden Morgen abgesammelt werden (pers. Beob., V. Bauer pers. Mittlg.). Auch im Inkubator sind am nächsten Morgen in aller Regel weitere Tiere geschlüpft, einige Eier angeritzt oder zeigen Schnittspuren. Genau in dieser Zeit ist die Gefahr Jungtiere zu verlieren, meiner Meinung nach extrem hoch. Einige Neonaten schaffen es vielleicht nicht selbstständig aus den Eiern.
Dort konnten sie dann am folgenden Morgen abgesammelt werden (pers. Beob., V. Bauer pers. Mittlg.). Auch im Inkubator sind am nächsten Morgen in aller Regel weitere Tiere geschlüpft, einige Eier angeritzt oder zeigen Schnittspuren. Genau in dieser Zeit ist die Gefahr Jungtiere zu verlieren, meiner Meinung nach extrem hoch. Einige Neonaten schaffen es vielleicht nicht selbstständig aus den Eiern. Das ist zumindest die Befürchtung der meisten Halter. Darum werden jetzt häufig auch alle restlichen Eier nervös angeschnitten. Es sei auch erwähnt, dass einige Züchter mit ihrem standardisierten Anschneiden sehr hohe Schlupferfolge verzeichnen.
Das ist zumindest die Befürchtung der meisten Halter. Darum werden jetzt häufig auch alle restlichen Eier nervös angeschnitten. Es sei auch erwähnt, dass einige Züchter mit ihrem standardisierten Anschneiden sehr hohe Schlupferfolge verzeichnen. Ob die Jungtiere alle selbstständig geschlüpft wären ist natürlich nicht mehr nachzuprüfen. Sind die Jungtiere aber schon abgestorben, nützt das Anschneiden der Eier natürlich auch nichts mehr. Leider erblicken viele Halter immer wieder auch Jungschlangen, die offensichtlich schon länger tot sind und nie eine Chance zum Schlupf gehabt haben. Solche
Ob die Jungtiere alle selbstständig geschlüpft wären ist natürlich nicht mehr nachzuprüfen. Sind die Jungtiere aber schon abgestorben, nützt das Anschneiden der Eier natürlich auch nichts mehr. Leider erblicken viele Halter immer wieder auch Jungschlangen, die offensichtlich schon länger tot sind und nie eine Chance zum Schlupf gehabt haben. Solche  Tiere sind in der Regel schlecht pigmentiert, haben zum Teil grünliche Verfärbungen an der Bauchseite sowie einen großen Eiweiß und Dottervorat übrig. Augenscheinlich sind diese Tiere mindestens 2-3 Tage abgestorben, vielleicht auch länger. Über genau solche Jungtiere reden wir hier.
Tiere sind in der Regel schlecht pigmentiert, haben zum Teil grünliche Verfärbungen an der Bauchseite sowie einen großen Eiweiß und Dottervorat übrig. Augenscheinlich sind diese Tiere mindestens 2-3 Tage abgestorben, vielleicht auch länger. Über genau solche Jungtiere reden wir hier.  Ob wir diese Eier anschneiden oder nicht ist letztendlich egal. Wir haben keinen Einfluss mehr über das Schicksal bereits abgestorbener Neonaten. Das Ergebnis hat sich völlig unbemerkt vor Tagen eingestellt. Aber was war der Auslöser dieser Tragödie ? Kann man diese Frage überhaupt mit Sicherheit beantworten?
Ob wir diese Eier anschneiden oder nicht ist letztendlich egal. Wir haben keinen Einfluss mehr über das Schicksal bereits abgestorbener Neonaten. Das Ergebnis hat sich völlig unbemerkt vor Tagen eingestellt. Aber was war der Auslöser dieser Tragödie ? Kann man diese Frage überhaupt mit Sicherheit beantworten?
Der Eitot – Auswertung möglicher Auslöser
Da diese Problematik in der Zucht von Morelia viridis, meinen Nachforschungen nach, noch nie wissenschaftlich untersucht wurde, kann man an dieser Stelle lediglich sämtliche Erfahrungen und Eindrücke verschiedener Halter wiedergeben, sowie entscheidende Auszüge aus fundierten Publikationen zusammentragen, um anstehende Brutversuche nach Möglichkeit zu optimieren. Absterbende Jungtiere kommen bei Halten in Europa sowie den USA gleichermaßen vor. 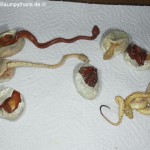 Oft wird über solche heiklen Themen aber nicht gerne geredet, ja der Verlauf sogar unter den Tisch gekehrt. Letztendlich möchte jeder lieber Erfolgsmeldungen weitergeben als von Rückschlägen zu berichten.
Oft wird über solche heiklen Themen aber nicht gerne geredet, ja der Verlauf sogar unter den Tisch gekehrt. Letztendlich möchte jeder lieber Erfolgsmeldungen weitergeben als von Rückschlägen zu berichten.  Aus genau diesem Grunde, stecken die vielleicht einfachen Lösungen solcher gravierenden Probleme, noch in den Kinderschuhen. Geschäftstüchtig ambitionierte Halter, sind natürlich ebenfalls nicht an einer allgemeinen Verbesserung der Lage interessiert, solange sie selbst hohe Schlupfquoten erzielen. Innerhalb der letzten Jahre habe ich viele Eindrücke, Theorien und Erfahrungen bei mir und vielen Haltern gesammelt. Einige gute Ansätze gingen mir auf meiner Suche nach möglichen Auslösern ins Netz. Auch Auszüge aus Publikationen, zum Thema Jungtiersterblichkeit während der Eizeitigung von Reptilieneiern im Allgemeinen, seien hier erwähnt bzw. zitiert.
Aus genau diesem Grunde, stecken die vielleicht einfachen Lösungen solcher gravierenden Probleme, noch in den Kinderschuhen. Geschäftstüchtig ambitionierte Halter, sind natürlich ebenfalls nicht an einer allgemeinen Verbesserung der Lage interessiert, solange sie selbst hohe Schlupfquoten erzielen. Innerhalb der letzten Jahre habe ich viele Eindrücke, Theorien und Erfahrungen bei mir und vielen Haltern gesammelt. Einige gute Ansätze gingen mir auf meiner Suche nach möglichen Auslösern ins Netz. Auch Auszüge aus Publikationen, zum Thema Jungtiersterblichkeit während der Eizeitigung von Reptilieneiern im Allgemeinen, seien hier erwähnt bzw. zitiert.  Einen Gedanken habe ich bei einem befreundeten Halter aufgefasst der seit einigen Jahren Grüne Baumpythons, ausschließlich in Naturbrut, züchtet. Er hat eine durchweg konstante Schlupfrate zwischen 95 und 100% (V Bauer pers. Mittlg.). Als Biologe sieht er die Reptilienhaltung natürlich in einem breiteren Fokus. Er hält seine Tiere grundsätzlich unter einem HQL Strahler. Entgegen den Ratschlägen der gängigen Literatur zum Thema Schlangenhaltung, die gezielte UVA Strahlung als unnötig beschreibt (Ross & Marzec 1994). Wer sagt denn, dass eine UV Strahlung in geringen Mengen, nicht zuträglich in der Entwicklung vitaler Eier ist? Jedes Tier unter der Sonne ist diesen Strahlen ausgesetzt. Im Blätterdach des Regenwaldes ist natürlich ebenfalls UV Strahlung vorhanden. Und das nicht zu knapp. Die Tatsache, dass Grüne Baumpythons vorwiegend nachtaktiv sind, reicht mir nicht aus. Auch im Dämmerlicht unter Blättern haben sie immer UV Bestrahlung. Vielleicht ist die Versorgung der Eier mit diversen lebenswichtigen Vitaminen, erst unter Verwendung von UV Bestrahlung, in ausreichender Menge gewährleistet.
Einen Gedanken habe ich bei einem befreundeten Halter aufgefasst der seit einigen Jahren Grüne Baumpythons, ausschließlich in Naturbrut, züchtet. Er hat eine durchweg konstante Schlupfrate zwischen 95 und 100% (V Bauer pers. Mittlg.). Als Biologe sieht er die Reptilienhaltung natürlich in einem breiteren Fokus. Er hält seine Tiere grundsätzlich unter einem HQL Strahler. Entgegen den Ratschlägen der gängigen Literatur zum Thema Schlangenhaltung, die gezielte UVA Strahlung als unnötig beschreibt (Ross & Marzec 1994). Wer sagt denn, dass eine UV Strahlung in geringen Mengen, nicht zuträglich in der Entwicklung vitaler Eier ist? Jedes Tier unter der Sonne ist diesen Strahlen ausgesetzt. Im Blätterdach des Regenwaldes ist natürlich ebenfalls UV Strahlung vorhanden. Und das nicht zu knapp. Die Tatsache, dass Grüne Baumpythons vorwiegend nachtaktiv sind, reicht mir nicht aus. Auch im Dämmerlicht unter Blättern haben sie immer UV Bestrahlung. Vielleicht ist die Versorgung der Eier mit diversen lebenswichtigen Vitaminen, erst unter Verwendung von UV Bestrahlung, in ausreichender Menge gewährleistet.  Ein amerikanischer Halter hat mir eine andere einleuchtende Theorie, im direkten Zusammenhang mit absterbenden Neonaten, vermittelt. Er zeitigt seine Eier von Morelia viridis immer künstlich mit der substratlosen Methode. Seine Vorgehensweise unterscheidet sich nicht von der in Europa verwendeten Technik. Außer in einem winzigen Detail. Er verwendet keine, wie in Internetforen und verschiedenen Publikationen beschrieben, absolut luftdichten Brutboxen, nein, er bohrt sogar immer noch einige kleine Luftlöcher in die Behälter. Zur Aufrechterhaltung, der sonst rapide absinkenden Luftfeuchte innerhalb moderner Motorbrüter, stellt er zusätzlich eine wassergefüllte Schale in den Brutraum. Somit wird dem Feuchtigkeitsverlust innerhalb der Brutboxen erfolgreich entgegengewirkt. Dieser winzige Unterschied, versorgt die Jungtiere sicher rund um die Uhr mit lebenswichtigem Sauerstoff, der gerade im Abschluss der Entwicklung dringend benötigt wird. Das gängige Schocklüften einmal täglich, ist womöglich nicht ausreichend genug. Unter Umständen sind die Poren der Eiinnenseiten mit kondensierten Wassermolekülen zusätzlich beschlagen und verstopft, was eine vernünftige Versorgung der Neonaten mit lebenswichtigem Sauerstoff erschwert. Dies, in Verbindung mit luftdicht versiegelten Brutdosen, könnte unter Umständen zur hohen Sterblichkeitsrate fertig entwickelter Jungtiere des Grünen Baumpythons, beitragen (R. Walder pers. Mittlg.).
Ein amerikanischer Halter hat mir eine andere einleuchtende Theorie, im direkten Zusammenhang mit absterbenden Neonaten, vermittelt. Er zeitigt seine Eier von Morelia viridis immer künstlich mit der substratlosen Methode. Seine Vorgehensweise unterscheidet sich nicht von der in Europa verwendeten Technik. Außer in einem winzigen Detail. Er verwendet keine, wie in Internetforen und verschiedenen Publikationen beschrieben, absolut luftdichten Brutboxen, nein, er bohrt sogar immer noch einige kleine Luftlöcher in die Behälter. Zur Aufrechterhaltung, der sonst rapide absinkenden Luftfeuchte innerhalb moderner Motorbrüter, stellt er zusätzlich eine wassergefüllte Schale in den Brutraum. Somit wird dem Feuchtigkeitsverlust innerhalb der Brutboxen erfolgreich entgegengewirkt. Dieser winzige Unterschied, versorgt die Jungtiere sicher rund um die Uhr mit lebenswichtigem Sauerstoff, der gerade im Abschluss der Entwicklung dringend benötigt wird. Das gängige Schocklüften einmal täglich, ist womöglich nicht ausreichend genug. Unter Umständen sind die Poren der Eiinnenseiten mit kondensierten Wassermolekülen zusätzlich beschlagen und verstopft, was eine vernünftige Versorgung der Neonaten mit lebenswichtigem Sauerstoff erschwert. Dies, in Verbindung mit luftdicht versiegelten Brutdosen, könnte unter Umständen zur hohen Sterblichkeitsrate fertig entwickelter Jungtiere des Grünen Baumpythons, beitragen (R. Walder pers. Mittlg.).  Die erhöhte Kohlendioxidausstoß der Eier zum anstehenden Schlupftermin, wurde als “Startsignal“ des bevorstehenden Schlupfes beschrieben (Highfield 1993). Ein Resultat daraus können frühzeitig geschlüpfte, bzw. im Ei verendete Neonaten sein. Falls der Schlupf glückt, sind diese Tiere oft schwach und weisen während der ersten Tage ihres Lebens eine hohen Sterblichkeitsrate auf. Mit etwas Glück, färben sie aber innerhalb der nächsten Wochen voll aus und entwickeln sich ansonsten normal (pers. Beob.).
Die erhöhte Kohlendioxidausstoß der Eier zum anstehenden Schlupftermin, wurde als “Startsignal“ des bevorstehenden Schlupfes beschrieben (Highfield 1993). Ein Resultat daraus können frühzeitig geschlüpfte, bzw. im Ei verendete Neonaten sein. Falls der Schlupf glückt, sind diese Tiere oft schwach und weisen während der ersten Tage ihres Lebens eine hohen Sterblichkeitsrate auf. Mit etwas Glück, färben sie aber innerhalb der nächsten Wochen voll aus und entwickeln sich ansonsten normal (pers. Beob.).  Es gibt auch Jungtiere die ihre schützende Hülle anschneiden, aber in den nächsten Stunden den Ausstieg nicht schaffen und letztendlich voll entwickelt absterben. Dies ist natürlich ebenfalls sehr dramatisch für Tier und Halter. Dabei scheint es keinen Unterschied zu machen, ob die Eier zuvor selbst angeschnitten wurden oder mechanisch geöffnet worden sind. Wobei der gefühlte Schwerpunkt der Sterblichkeitsrate auf das Konto mechanisch geöffneter Eier zu gehen scheint (pers. Beob.). Wie in einem meiner Artikel zuvor schon erwähnt, könnte dies mit dem aufzehren des Dotters zur Schlupfzeit, in unmittelbarem Zusammenhang stehen (Kroneis 2010). Da der Ei Inhalt nach dem Öffnen recht schnell in Verwesung übergeht, wir aber den exakten Schlupfzeitpunkt jedes einzelnen Eies nicht kennen, könnte sich dadurch das junge Leben selbst vergiften. Sobald die Eihülle aufgeschnitten ist, beginnt unweigerlich der Zerfall des gesamten Organismus. Das Jungtier muss sich umgehend von dieser biologischen Bombe trennen. Saugt es allerdings, aufgrund einer voreiligen Geburtshilfe den in Verwesung übergegangenen Ei Inhalt auf, könnte dies eine Ursache für das Absterben schlupfreifer Jungtiere sein. Eine solche Vergiftung wäre auch eine denkbare Erklärung für das mysteriöse Versterben einzelner Jungtiere innerhalb der ersten 2-3 Lebenstage.
Es gibt auch Jungtiere die ihre schützende Hülle anschneiden, aber in den nächsten Stunden den Ausstieg nicht schaffen und letztendlich voll entwickelt absterben. Dies ist natürlich ebenfalls sehr dramatisch für Tier und Halter. Dabei scheint es keinen Unterschied zu machen, ob die Eier zuvor selbst angeschnitten wurden oder mechanisch geöffnet worden sind. Wobei der gefühlte Schwerpunkt der Sterblichkeitsrate auf das Konto mechanisch geöffneter Eier zu gehen scheint (pers. Beob.). Wie in einem meiner Artikel zuvor schon erwähnt, könnte dies mit dem aufzehren des Dotters zur Schlupfzeit, in unmittelbarem Zusammenhang stehen (Kroneis 2010). Da der Ei Inhalt nach dem Öffnen recht schnell in Verwesung übergeht, wir aber den exakten Schlupfzeitpunkt jedes einzelnen Eies nicht kennen, könnte sich dadurch das junge Leben selbst vergiften. Sobald die Eihülle aufgeschnitten ist, beginnt unweigerlich der Zerfall des gesamten Organismus. Das Jungtier muss sich umgehend von dieser biologischen Bombe trennen. Saugt es allerdings, aufgrund einer voreiligen Geburtshilfe den in Verwesung übergegangenen Ei Inhalt auf, könnte dies eine Ursache für das Absterben schlupfreifer Jungtiere sein. Eine solche Vergiftung wäre auch eine denkbare Erklärung für das mysteriöse Versterben einzelner Jungtiere innerhalb der ersten 2-3 Lebenstage.  Auch körperliche Anomalien können auftreten und einen erfolgreichen Schlupf verhindern. Das Fehlen des Eizahnes soll schon vorgekommen sein (Köhler 1997). Dies dürfte in der Praxis aber in den seltensten Fällen tatsächlich die Ursache abgestorbener Morelia viridis sein. Ich habe bislang weder von einem verstorbenen Schlüpfling ohne ausgebildeten Eizahn gelesen, noch wurde mir ein solcher Bericht mündlich zugetragen.
Auch körperliche Anomalien können auftreten und einen erfolgreichen Schlupf verhindern. Das Fehlen des Eizahnes soll schon vorgekommen sein (Köhler 1997). Dies dürfte in der Praxis aber in den seltensten Fällen tatsächlich die Ursache abgestorbener Morelia viridis sein. Ich habe bislang weder von einem verstorbenen Schlüpfling ohne ausgebildeten Eizahn gelesen, noch wurde mir ein solcher Bericht mündlich zugetragen. Falls ein solcher Fall tatsächlich auftritt, ist er ein tragischer Einzelfall aber prozentual wohl sicher zu vernachlässigen. Er trägt also nicht maßgeblich zum mysteriösen Absterben der Jungtiere bei. Des weiteren wurden mütterliche Antikörper, sogenannte Immunglobuline in Reptilieneiern erwähnt, die im Muttertier bereits Resistenzen gebildet haben und dem Jungtier über den Dotter, einen ersten Schutz gegenüber Infektionskrankheiten liefern (Junghans 1997).
Falls ein solcher Fall tatsächlich auftritt, ist er ein tragischer Einzelfall aber prozentual wohl sicher zu vernachlässigen. Er trägt also nicht maßgeblich zum mysteriösen Absterben der Jungtiere bei. Des weiteren wurden mütterliche Antikörper, sogenannte Immunglobuline in Reptilieneiern erwähnt, die im Muttertier bereits Resistenzen gebildet haben und dem Jungtier über den Dotter, einen ersten Schutz gegenüber Infektionskrankheiten liefern (Junghans 1997).  Daraus folgt ein unmittelbarer Zusammenhang zwischen der Gesundheit der Elterntiere, der Anfälligkeit des zu erwartenden Geleges, gegenüber einem Krankheitsbefall und sonstiger Schwächen. Auch der Kalziumgehalt der Eischale ist in der finalen Phase von Bedeutung. Gegen Ende der Inkubationszeit wird vom heranwachsenden Embryo Kalzium aus der Eischale mobilisiert.
Daraus folgt ein unmittelbarer Zusammenhang zwischen der Gesundheit der Elterntiere, der Anfälligkeit des zu erwartenden Geleges, gegenüber einem Krankheitsbefall und sonstiger Schwächen. Auch der Kalziumgehalt der Eischale ist in der finalen Phase von Bedeutung. Gegen Ende der Inkubationszeit wird vom heranwachsenden Embryo Kalzium aus der Eischale mobilisiert.  Diese Resorption verringert die Schichtdicke der Hülle geringfügig, was einen Schlupf zusätzlich erleichtert (Hartmann 2009). Dicke und zu stark eingetrocknete Schalen stellen hingegen ein unüberwindbares Hindernis dar.
Diese Resorption verringert die Schichtdicke der Hülle geringfügig, was einen Schlupf zusätzlich erleichtert (Hartmann 2009). Dicke und zu stark eingetrocknete Schalen stellen hingegen ein unüberwindbares Hindernis dar.  Die Luftfeuchte ist ein weiterer wichtiger Faktor beim erfolgreichen Schlupf von Morelia viridis. Bei relativ trocken gezeitigten Eiern ist gegen Ende der Brut, eine höhere Harnstoffsättigung des Blutspiegels festzustellen. Der Harnstoffspiegel wird normalerweise durch einen ausgewogenen Wasserhaushalt, vor allem bei der später erhöhten Stoffwechselintensität, auf ein zuträgliches Maß verdünnt. Eine trockene Eizeitigung kann dadurch eine frühe Schädigung der Nieren auslösen was zu schwachen Jungtieren führen kann, die den Schlupf unter Umständen nicht schaffen bzw. bald darauf verenden (Köhler 1997). Selbst manuell geöffnet, sterben stark dehydrierte Jungtiere oft während oder bald nach dem Schlupf ab. Ich konnte während eines missglückten Brutgeschäftes einige Jungtiere aus dehydrierten Eiern bergen. Optisch sahen Sie wunderbar und makellos aus. Mir viel allerdings auf, dass kein Tier “züngelte“.
Die Luftfeuchte ist ein weiterer wichtiger Faktor beim erfolgreichen Schlupf von Morelia viridis. Bei relativ trocken gezeitigten Eiern ist gegen Ende der Brut, eine höhere Harnstoffsättigung des Blutspiegels festzustellen. Der Harnstoffspiegel wird normalerweise durch einen ausgewogenen Wasserhaushalt, vor allem bei der später erhöhten Stoffwechselintensität, auf ein zuträgliches Maß verdünnt. Eine trockene Eizeitigung kann dadurch eine frühe Schädigung der Nieren auslösen was zu schwachen Jungtieren führen kann, die den Schlupf unter Umständen nicht schaffen bzw. bald darauf verenden (Köhler 1997). Selbst manuell geöffnet, sterben stark dehydrierte Jungtiere oft während oder bald nach dem Schlupf ab. Ich konnte während eines missglückten Brutgeschäftes einige Jungtiere aus dehydrierten Eiern bergen. Optisch sahen Sie wunderbar und makellos aus. Mir viel allerdings auf, dass kein Tier “züngelte“.  Trotz ansonsten normalem Verhalten, starben ausnahmslos alle Tiere, innerhalb der ersten Lebenswoche. Durch einen verzögerten Eiablagetermin ist es nachweislich auch schon zum Absterben fertig entwickelter Jungtiere gekommen. Allerdings wurde diese interessante Beobachtung bei Krokodilen gemacht. Dort wurden auf Eischalen abgestorbener Jungtiere eine geringere Anzahl von Poren festgestellt, die teilweise noch zusätzlich verstopft waren (Hartmann 2009). Es wäre in diesem Zusammenhang interessant zu beobachten, ob bei weit hinausgezögerten Eiablagen des Grünen Baumpythons, eine vermehrte Anzahl von absterbenden Jungtieren zu verzeichnen ist.
Trotz ansonsten normalem Verhalten, starben ausnahmslos alle Tiere, innerhalb der ersten Lebenswoche. Durch einen verzögerten Eiablagetermin ist es nachweislich auch schon zum Absterben fertig entwickelter Jungtiere gekommen. Allerdings wurde diese interessante Beobachtung bei Krokodilen gemacht. Dort wurden auf Eischalen abgestorbener Jungtiere eine geringere Anzahl von Poren festgestellt, die teilweise noch zusätzlich verstopft waren (Hartmann 2009). Es wäre in diesem Zusammenhang interessant zu beobachten, ob bei weit hinausgezögerten Eiablagen des Grünen Baumpythons, eine vermehrte Anzahl von absterbenden Jungtieren zu verzeichnen ist.
Zu guter Letzt
Auf meinem Weg zur Vorbereitung dieses Artikels habe ich erfahren, dass leider viele  Halter und Züchter mit diesen Problemen ihre Erfahrungen sammeln mussten. Einige Verfechter der künstlichen Inkubation, haben mittlerweile für sich bewährte Systeme gefunden, die eine akzeptable Schlupfquote jenseits der 80 – 90% liefern ( pers. Mittlg S. Seidel, M. Köger ). Auch in der Naturbrut gibt es Züchter mit hohem Erfolg ( pers. Mittlg S. Arth & S. Baus, M. Weier, V. Bauer).
Halter und Züchter mit diesen Problemen ihre Erfahrungen sammeln mussten. Einige Verfechter der künstlichen Inkubation, haben mittlerweile für sich bewährte Systeme gefunden, die eine akzeptable Schlupfquote jenseits der 80 – 90% liefern ( pers. Mittlg S. Seidel, M. Köger ). Auch in der Naturbrut gibt es Züchter mit hohem Erfolg ( pers. Mittlg S. Arth & S. Baus, M. Weier, V. Bauer).  Die Mehrheit der Halter, wird aber leider immer wieder mit Rückschlägen konfrontiert. Aus welchen Gründen auch immer. Bestehende Zuchtgruppen liefern in einem Jahr Gelege mit annähernden 100 % Schlupferfolg, im nächsten Jahr bei gleicher Haltung, folgen Nullrunden. Der Schnitt über mehrere Gelege bewegt sich meist um 70 – 80%. Viele Faktoren scheinen eine Rolle in der Zucht des Grünen Baumpythons zu spielen. Der Fokus muss breitgefächert angelegt werden. Die ganzjährige Haltung, ja selbst die Ernährung der Futtertiere, muss vielleicht überdacht werden. Aber auch winzige Details scheinen nicht ohne Konsequenz zu bleiben. Wichtig ist, dass immer weitere Ausfeilen der Haltung und Technik sowie ein konsequentes Protokollieren der Ergebnisse. Bei folgendem regen Austausch der Erfahrungen stellt dieses Thema, wie schon viele andere Erfolge in der Terraristik, in naher Zukunft vielleicht kein Problem
Die Mehrheit der Halter, wird aber leider immer wieder mit Rückschlägen konfrontiert. Aus welchen Gründen auch immer. Bestehende Zuchtgruppen liefern in einem Jahr Gelege mit annähernden 100 % Schlupferfolg, im nächsten Jahr bei gleicher Haltung, folgen Nullrunden. Der Schnitt über mehrere Gelege bewegt sich meist um 70 – 80%. Viele Faktoren scheinen eine Rolle in der Zucht des Grünen Baumpythons zu spielen. Der Fokus muss breitgefächert angelegt werden. Die ganzjährige Haltung, ja selbst die Ernährung der Futtertiere, muss vielleicht überdacht werden. Aber auch winzige Details scheinen nicht ohne Konsequenz zu bleiben. Wichtig ist, dass immer weitere Ausfeilen der Haltung und Technik sowie ein konsequentes Protokollieren der Ergebnisse. Bei folgendem regen Austausch der Erfahrungen stellt dieses Thema, wie schon viele andere Erfolge in der Terraristik, in naher Zukunft vielleicht kein Problem  mehr da.
mehr da. Das Durchhalten nach einer Serie von Tiefschlägen, “trennt die Spreu vom Weizen“, womit mich S. Arth nach einem vergeigten Brutgeschäft scherzhaft ermutigte. In meinem persönlichen Eindruck der aktuellen Situation, spiegelt sich zur Zeit dieses Artikels, die Überlegenheit der Naturbrut gegenüber der Kunstbrut wieder. Speziell wenn es um das Absterben vollentwickelter, schlupfreifer Jungtiere, wie in diesem Artikel, geht.
Das Durchhalten nach einer Serie von Tiefschlägen, “trennt die Spreu vom Weizen“, womit mich S. Arth nach einem vergeigten Brutgeschäft scherzhaft ermutigte. In meinem persönlichen Eindruck der aktuellen Situation, spiegelt sich zur Zeit dieses Artikels, die Überlegenheit der Naturbrut gegenüber der Kunstbrut wieder. Speziell wenn es um das Absterben vollentwickelter, schlupfreifer Jungtiere, wie in diesem Artikel, geht. 
 Bei jährlich gleichen Voraussetzungen werden konstantere Serien erzielt. Die Anzahl im Ei abgestorbener Jungtiere scheint, über mehrere Gelege gesehen, niedriger zu liegen. Wird die heimische Bruttechnik beherrscht, dürfte der Schnitt auch in der gesamten Schlupfquote sehr hoch liegen.
Bei jährlich gleichen Voraussetzungen werden konstantere Serien erzielt. Die Anzahl im Ei abgestorbener Jungtiere scheint, über mehrere Gelege gesehen, niedriger zu liegen. Wird die heimische Bruttechnik beherrscht, dürfte der Schnitt auch in der gesamten Schlupfquote sehr hoch liegen.  Vielleicht kann ein weiblicher
Vielleicht kann ein weiblicher  Morelia viridis doch besser brüten!?
Morelia viridis doch besser brüten!?
Uns  bleiben nur weitere Versuche und ein reger Erfahrungsaustausch. Denn die Hoffnung stirbt zuletzt……………..
bleiben nur weitere Versuche und ein reger Erfahrungsaustausch. Denn die Hoffnung stirbt zuletzt……………..
Literaturnachweis zu Eitot
Arth, S. & S. Baus (2006): Der Grüne Baumpython – Morelia viridis. – Natur und Tier Verlag, Münster, 63 S.
Bellairs, A., (1971): Die Reptilien. – Editions Rencontre Lausanne
Hartmann, C. (2009):Untersuchungen zur Zusammensetzung von Reptilieneiern, Inaugural Dissertation
Highfield, A. (1993): An effective method of artificial incubation for Mediterranean tortoise eggs -The Vivarium 5 (1). 15–17.
Junghans, R. (1997): IgG Biosynthesis: No ‘‘Immunoregulatory Feedback’’.- Bloodjournal Vol.90 Nr 10, S. 3815 – 3818
Kivit, R. & S. Wiseman (2000): Grüner Baumpython und Grüne Hundkopfboa. –und Seufer Verlag, Keltern / Weiler, 126 S.
Kroneis, M. (2010): Der Grüne Baumpython – Terrarienanlage und Technik. – Terraria, Münster, (23): 14 – 28.
Kroneis, M. (2010): Der Grüne Baumpython – Durch Naturbrut zum Erfolg. – Draco, Münster, (44): 38 – 59.
Köhler, G. (1997): Inkubation von Reptilieneiern. – Herpeton Verlag, Offenbach, 205 S.
Maxwell, G. (2005): Morelia viridis – Das Kompendium. – Edition Chimaira, Frankfurt/Main, 317 S.
Nietzke, G. (1984): Fortpflanzung und Zucht der Terrarientiere.-Landbuch Verlag, Hannover, 237 S.
O`Shea, M. (2007): Boas und Pythons der Welt. – Ulmer Verlag, Stuttgart, 158 S.
Rawlings L.H. (2002): Phylogeographic analysis of the green python, Morelia viridis. Reveals cryptic diversity, Academic Press, 27: 36-44.
Ross, A. & G. Marzec (1994): Riesenschlangen – Zucht und Pflege. – Bede Verlag, Ruhmannsfelden, 245 S.
Schmidt, D. (1994): Vermehrung von Terrarientieren – Schlangen. – Urania Verlag, Leipzig, 200 S.
Switak, K.H. (2006): Adventures in Green Python Country. – Natur und Tier Verlag, Münster, 363 S.
Trutnau, L. (1988): Schlangen 1. – Ulmer Verlag, Stuttgart, 3. Aufl., 256 S.
Walls, J.G. (1998): The Living Pythons. – T.F.H. Publications INC., Neptune, NJ, USA, 255 S.
Weier, M. & R. Vitt (1999): Der Grüne Baumpython. – Herpeton Verlag, Offenbach, 110 S.
Wilson D. (2011): On green pythons- The conservation and ecology of Morelia viridis.-Lambert Academic publishing, Saarbrücken, 104 S.

